メッキと加熱でオリンピックメダルカラー(金銀銅)のように3種類の金属を並べてみようというもの。
□いったん溶け出した亜鉛が銅板上で半電池反応により還元されてメッキ層をつくります。さらに、そのまま火であぶることで、表面に合金の黄銅ができるというもの。
「動 画」操作解説動画_学生による演示
□メダルカラーの金銀ともとの銅板を並べると壮観です。
「動 画」残存物の亜鉛粉末の処理注意!
□廃棄物の処理に注意が必要です:実験後に残った亜鉛粉末を燃えやすいものと一緒にしておくと、短時間で着火することがあります。アルカリとの反応で表面の酸化物が溶け去り、反応性が高くなっているものと考えられます。動画では、紙がぬれていても、熱で水分が蒸発し、着火しています。ゴミ箱に捨てると短時間で燃え上がることもあり極めて危険です。金属製の器に入れて完全に酸化させるなどして処理してください。なお、すでに何件か事故が報告されており、慎重な取り扱いが必要です。
「解 説」
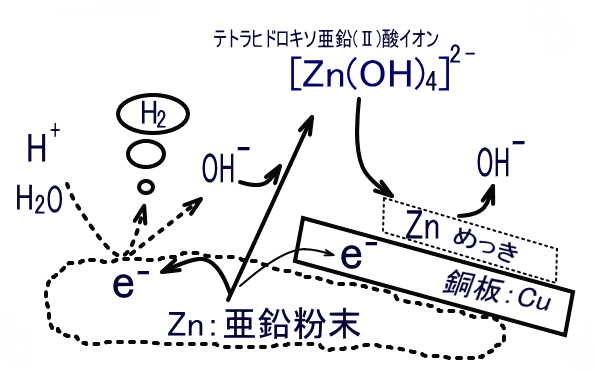
一度溶けた亜鉛が還元されて析出する:両性元素である亜鉛は、塩基である水酸化ナトリウムと反応して酸化され、テトラヒドロキソ亜鉛(Ⅱ)酸イオン [Zn(OH)4]2- を形成します(①)。同時に、水が還元(②)されて水素が発生しますが、この反応は強塩基性下であり、水素過電圧が大きいことによりかなり抑えられます。しかし、銅の投入により未反応の亜鉛と接触することで局部電池が構成されます。銅板側に電子が供給されるので、水溶液中に存在するテトラヒドロキソ亜鉛(Ⅱ)酸イオン[Zn(OH)4]2-は還元され、そのまま銅板上に亜鉛メッキ層ができる(①の逆反応)というものです。亜鉛と銅のイオン化傾向を比較して、亜鉛が析出することを不思議がる向きがありますが、銅は単に電子の受け渡しの役割を果たしているだけです。
① Zn + 4OH– → [Zn(OH)4]2- + 2e–
② 2H2O + 2e– → H2 + 2OH–
まるで錬金術のよう:銅の表面に析出した亜鉛は銀色に輝き美しい金属光沢を放ちます。亜鉛の融点は約420℃、銅は1083℃と高いのですが、亜鉛のメッキができたところを加熱すると、溶けた亜鉛に固体の銅板の表面の一部が溶け込んで合金ができると考えられています。亜鉛と銅が溶融してできる合金は、黄銅または真鍮(しんちゅう)として古くから知られ、黄金色をしているので、様々な装飾品に用いられてきました。黄銅は英語のbrassのことで、吹奏楽がブラスバンドと呼ばれるのは、使用される金管楽器の素材が黄銅であったことに由来するものです。また、特に金色の光沢を放つので、この実験自体がまるで錬金術のような趣があります。
なお、10円硬貨などの原稿貨幣を用いることはしないでください。教育的、学術目的の場合は、直ちに犯罪を構成しないのですが、わざわざリスクを冒すことのないようにしてください。
◇このブログで発信する情報は、取扱いに注意を要する内容を含んでおり、解説の一部を非公開にしてあります。操作には一定のスキル・環境を要しますので、記事や映像を見ただけで実験を行うことは絶対(!)にしないで下さい。詳細は、次の3書(管理者の単著作物)でも扱っているものが多いので参考にして下さい。
◇著書(単著):『サクッと!化学実験(dZERO)』『高校教師が教える化学実験室』『実験マニア(亜紀書房)』



