塩化コバルトの結晶を水に溶かすと淡桃色のアクア錯イオンとなって安定します。これに濃塩酸を加えると色が青色に変化するなど、これらは錯イオンの立体構造の変化によるものです。
「動 画」塩化コバルト結晶を加熱~水溶液~熱による水離脱
「解 説」
1.水の吸収により色が変わる:塩化コバルト(Ⅱ) CoCl2・6H2O は、水の配位数によりカラフルな化合物をつくることで知られます。加熱すると、水和している水分子が離脱して青色を呈しますが、放置しておくと次第に空気中の水分を吸収して水和物に戻ります。
CoCl2・ 6H2O ⇄ CoCl2 + 6H2O
(暗紫色) (青色)
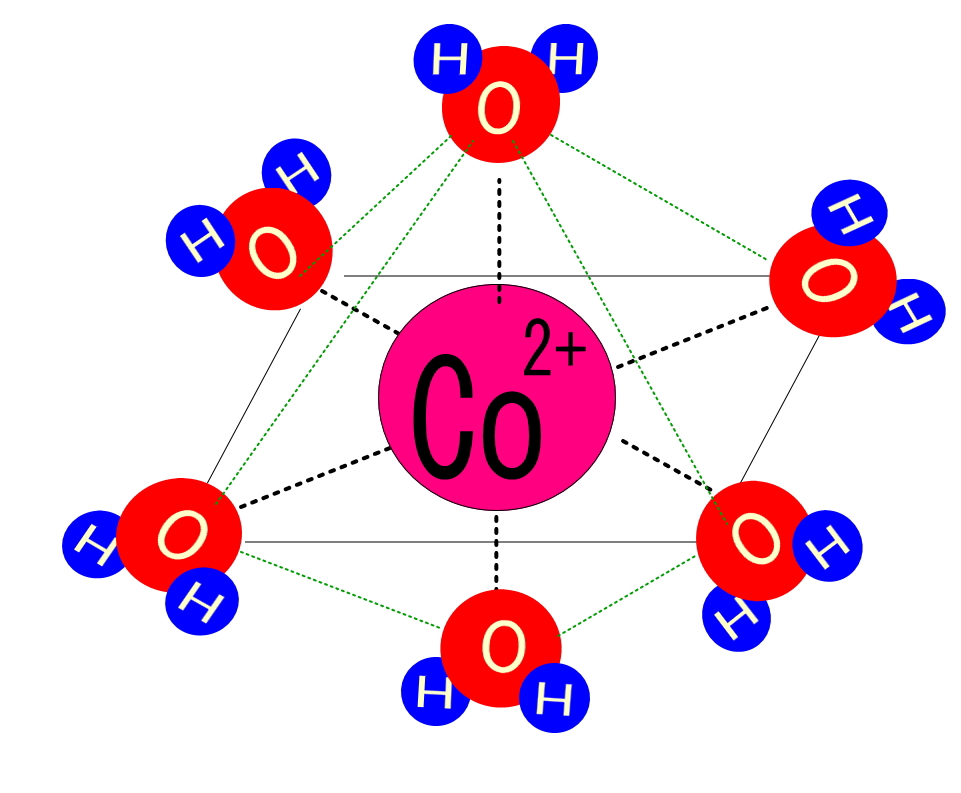
この六水和物を水に溶解させると、淡桃色のヘキサアクア錯イオンをつくって安定します。無水物から水和物へと水を吸収していく過程で青色から淡赤色へと色調が変わるので、乾燥剤のシリカゲル粒や化学反応で水が生成しているかどうかの判定剤としても利用されます。
CoCl2・6H2O ⇄ [Co(H2O)6]2+ + 2Cl-
2.配位数が6→4に変化する:塩化コバルトを水に溶解させたのち、さらに濃塩酸を加えると、水分子と塩化物イオンの交換が起こり、テトラクロロコバルト(Ⅱ)酸イオン [CoCl4]2- が生成します。
[Co(H2O)6]2+ + 4Cl– ⇄ [CoCl4]2- + 6H2O
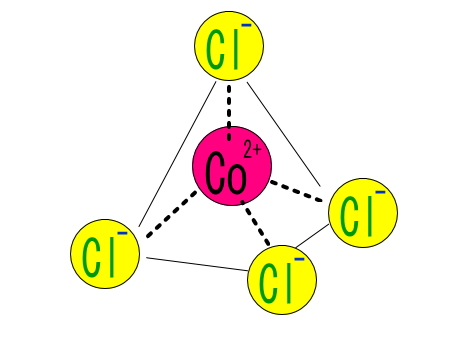
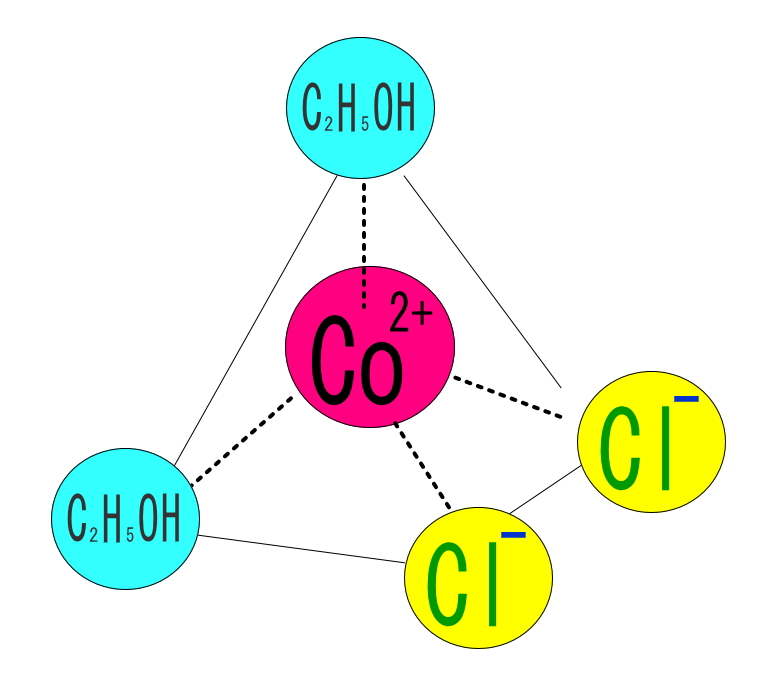
この変化では、コバルト錯イオンの構造が八面体から四面体、配位数が6→4に減少します。また、吸熱反応を伴う可逆反応で、温度を上げていくと、微妙な色の変化も観察できます。クロモトロピズムの一種であり、定量検査にも活用されることがあります。なお、エタノールに水を加えていき色列をつくる操作では、エタノール分子(または塩化物イオン)が四面体構造の錯体を構成して青色を呈しているところから、次第に淡赤色に変化するので色変化は逆になります。
◇このブログで発信する情報は、取扱いに注意を要する内容を含んでおり、解説の一部を非公開にしてあります。操作には一定のスキル・環境を要しますので、記事や映像を見ただけで実験を行うことは絶対(!)にしないで下さい。詳細は、次の3書(管理者の単著作物)でも扱っているものが多いので参考にして下さい。
◇著書(単著):『サクッと!化学実験(dZERO)』『高校教師が教える化学実験室』『実験マニア(亜紀書房)』



